גישה חדשה ומותאמת-אישית עשויה לשפר באופן ניכר את היכולת של תאי המערכת החיסונית לזהות תאים סרטניים ולהשמידם.
שיעורי ההחלמה מסרטן העור מסוג מלנומה עלו באופן ניכר בשנים האחרונות הודות לטיפולים אימונותרפיים חדשים אשר רותמים בהצלחה את תאי המערכת החיסונית למלחמה בסרטן. במקרים מסוימים של סרטן זה, הגיעו שיעורי ההחלמה אף לכ-50%. ממחקר חדש של מדעני מכון ויצמן למדע עולה כי שיעורי ההחלמה יכולים להיות גבוהים עוד יותר: גישה חדשה ומותאמת-אישית עשויה לשפר באופן ניכר את היכולת של תאי המערכת החיסונית לזהות תאים סרטניים ולהשמידם. ממצאים אלה מתפרסמים היום בכתב-העת המדעי Cancer Discovery.
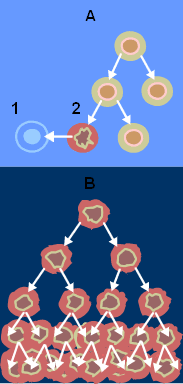
הטיפולים האימונותרפיים הזמינים כיום מבוססים על אחת משתי שיטות – מתן נוגדנים אשר מעוררים לפעולה את תאי T של המערכת החיסונית בגופו של החולה או גידול והפעלה של תאי T במעבדה והחזרתם לגוף החולה בגרסה "לוחמנית" יותר. "אבל אף אחת מהשיטות לא תוביל לחיסול הסרטן, כל עוד תאי המערכת החיסונית לא יצליחו לקרוא את ה'תמרורים' אשר מסמנים את תאי הסרטן בתור גורם זר שיש להילחם בו", מסבירה פרופ' ירדנה סמואלס מהמחלקה לביולוגיה מולקולרית של התא.
מעבדות מסביב לעולם מקדישות כיום מחקרים רבים לחיפוש תמרורים אלה המכונים "ניאו-אנטיגנים": פפטידים שמכילים מוטציה של התא הסרטני, ונמצאים על פני הקרומים של התאים הסרטניים. זיהוי הפפטידים שיכולים לשמש כתמרורים לתאי T, עשוי לסייע לפתח חיסונים מותאמים-אישית נגד סרטן. ואולם, אחת הבעיות בזיהוי תמרורים אלה בסרטן מסוג מלנומה היא שהם מהווים חלק ממערך חלבוני הנקרא HLA, אשר יכול להופיע באלפי צורות – וזה עוד מבלי שהבאנו בחשבון את המוטציות הסרטניות המוצגות. לפיכך, חוקרים שניסו לחפש תמרורים אפשריים בגנום של התא הסרטני בעזרת אלגוריתמים העלו בחכתם מאות רבות של מועמדים אפשריים הדורשים בדיקה.
פרופ' סמואלס עם תלמידת המחקר שלה שלי קלאורה, ובשיתוף פרופ' אריה אדמון מהטכניון, עקפה את הצורך באלגוריתם וצימצמה באופן ניכר את מספר המועמדים. המדענים השתמשו בשיטה שפיתח פרופ' אדמון כדי להפריד פפטידים מתוך הסבך החלבוני שעל גבי תאי המלנומה, ולאחר מכן בדקו כיצד מגיבים תאי המערכת החיסונית לפפטידים אלה. אומרת פרופ' סמואלס: "בשיטה זו, גילינו הרבה פחות תמרורים ממה שאפשר היה לצפות. השיטה הייתה כה יעילה, עד שתאי T שידעו לקרוא את התמרור שזיהינו, חיסלו 90% מתאי המטרה הסרטניים – גם בתרבית וגם בעכברים. ממצאים אלה מצביעים על יישומים קליניים אפשריים". המדענים שיתפו פעולה עם צוות שכלל את ד"ר איתן רופין מהמכון הלאומי לסרטן בארצות הברית, ד"ר ג'נפיר ווארגו מהמרכז לסרטן על-שם מ.ד. אנדרסון באוניברסיטת טקסס, ופרופ' ניר פרידמן מהמחלקה לביולוגיה מולקולרית של התא במכון.
החוקרים בדקו גם אם אותם התמרורים מופיעים בגרורות הסרטניות שהתפשטו בקרב חלק מהחולים. "זו הפעם הראשונה שבה נחקרו פפטידים מגרורות שונות של אותו החולה", מספרת קלאורה. "כדי להנחית מהלומה מערכתית על הסרטן בחולים עם גרורות, הכרחי לזהות לא רק פפטידים מעוררי תגובה חיסונית הנמצאים על גבי התאים הסרטניים, אלא כאלה אשר נמצאים גם בתאי הגרורות בגופו של החולה".
בהמשך לקחו המדענים את הממצאים צעד קדימה: הם הוציאו דגימות של תאי T מ-14 חולים ובדקו כיצד הם מגיבים ל"ניאו-אנטיגנים" שזוהו. לאחר מכן בחרו את התאים שהגיבו באופן החזק ביותר, ריצפו את הגנום שלהם, גידלו אותם במעבדה, והזריקו לעכברים שהושתלו בהם תאים סרטניים מגופם של החולים. החוקרים הראו כי תאי ה-T שנבחרו היו יעילים יותר בחיסול הסרטן, הן בתרביות והן בעכברים.
מסכמת פרופ' סמואלס: "על אף שמדובר בשלב זה במחקר ניסויי, הממצאים רלוונטיים ביותר גם למחקר קליני, שכן טיפולים נוגדי סרטן המבוססים על 'ניאו-אנטיגנים', מבוססים מחקרית. בהינתן העובדה שכמעט כל הניאו-אנטיגנים שזיהינו עד כה בחולים היו ייחודיים גם לחולים וגם לרקמה הסרטנית הספציפית – הם מהווים בנק מטרות אידיאלי לטיפולים נוגדי סרטן. זו עשויה להיות הרפואה המותאמת-אישית האולטימטיבית – תרופה ייחודית חדשה לכל חולה".
השתתפו במחקר גם ד"ר יוחאי וולף, ד"ר איתי תירוש, נואר קוטוב, פולינה גרינברג ורונן לוי מהמחלקה לביולוגיה מולקולרית של התא במכון; פרופ' גיא שחר, טלי פפרמן, ארז גרינשטיין ודן רשף מהמחלקה לאימונולוגיה במכון; עפרה גולני מהמחלקה לתשתיות מחקר מדעי החיים במכון; אילון ברנע מהטכניון; אלכסנדר ראובן, ג'יאנווה ג'אנג, שידזנג מאו, שינגג'ה סונג, שנטל ברנצ'ז, קרה הימייקר, מרי-אנדרה פורגט, קייתלין קריסי, ברט קרטר וזקארי קופר מהמרכז לסרטן על-שם מ.ד. אנדרסון באוניברסיטת טקסס; פרופ' סטיבן רוזנברג וסושאנט פטקר מהמכון הלאומי לסרטן, ארה"ב; ג'וליאנה קווינקרדט ותנה אומוקוקו מהחברה הגרמנית BioNTech; מיכל לוטם מהמרכז הרפואי הדסה בירושלים, ואוגור שאהין מהמרכז הרפואי של אוניברסיטת מיינץ, גרמניה.